Kniegelenk: Knorpelschäden

Therapieoptionen bei Knorpelschäden
Das Kniegelenk gehört zu den am stärksten belasteten Gelenken des menschlichen Körpers. Es wundert deshalb nicht, dass am Kniegelenk besonders häufig frühzeitig Knorpelschäden auftreten. Der Verlust von Knorpelsubstanz ist grundsätzlich irreversibel und progredient. Die Konsequenz lautet: Gonarthrose. Umso wichtiger ist, dass einerseits Risikofaktoren rechtzeitig erkannt und andererseits Knorpelschäden frühzeitig diagnostiziert und behandelt werden. Wir möchten Ihnen in dieser Ausgabe von IM FOKUS eine praxisrelevante Übersicht zum Thema Gelenkknorpel beziehungsweise der Diagnose und Therapie von Knorpelschäden des Kniegelenks geben. Die getroffenen Kernaussagen sind prinzipiell selbstverständlich auf Knorpelschäden anderer Gelenke übertragbar. Knorpelschäden: Volkswirtschaftlich bedeutsam
Studien zeigen, dass allein in Deutschland ca. 30 Millionen Arztkonsultationen, 50 Millionen Arbeitsausfalltage und mehr als 5 Millionen Krankenhaustage auf degenerative Gelenkerkrankungen zurückzuführen sind. Der Verschleiß eines Gelenkes beginnt in aller Regel mit einem Knorpelschaden. Mit Versprechungen bezüglich Knorpelheilung als Wundermittel gegen Arthrose weckt gerade auch die Laienpresse immer wieder großes Interesse.

Knorpel: Das sind die Fakten
Biologische Grundlagen
Knorpelgewebe ist ein festes sowohl druck- als auch biegungselastisches Stützgewebe. Man unterscheidet drei unterschiedliche Knorpelarten: Faserknorpel (z. B. Bandscheibe), elastischer Knorpel (z. B. Ohrmuschel) und hyaliner Knorpel, der die Gelenkenden überzieht. Hyaliner Knorpel ist nicht vaskularisiert, besitzt keine nervale und keine Lymphgefäßversorgung und weist zudem eine relativ geringe Zellularität auf. Diese biologischen Besonderheiten bedingen, dass Schäden des Gelenkknorpels nahezu kein Selbstheilungspotenzial besitzen.
Knorpelfunktion
Als Überzug von Gelenken ist hyaliner Knorpel für die Verteilung der einwirkenden Kräfte verantwortlich und reduziert die Beanspruchung der am Gelenkaufbau beteiligten knöchernen Strukturen. Knorpel kombiniert in einzigartiger Weise Steifheit, Elastizität und niedrigen Reibungskoeffizienten. Bis heute gibt es keinen vergleichbaren industriellen Werkstoff der solche Qualitäten aufweist. Die hohe Funktionalität kann das hyaline Knorpelgewebe vielfach über sieben oder acht Lebensdekaden beibehalten, ohne dass es zu wesentlichen Störungen der Gelenkfunktion kommt.
Morphologie des Gelenkknorpels
Knorpelgewebe besteht aus zellulären und extrazellulärent Bestandteilen, d. h. aus Knorpelzellen und aus extrazellulärer Knorpelmatrix. Der histologische Querschnitt durch die Gelenkoberfläche zeigt eine zonale Gliederung des Knorpels. Es können vier Schichten voneinander abgegrenzt werden: Die Gelenkoberfläche wird durch die dünne Superfizialschicht gebildet. Es folgt die breite Radiärzone (Mittelzone). Daran schließt sich die tiefe Zone an, die durch die sogenannte Tidemark, ein dünnes Band mit höherem Calciumgehalt, von der Schicht des mineralisierten Knorpels getrennt wird.
Biochemische Zusammensetzung von Gelenkknorpel
Gelenkknorpel zeichnet sich durch eine recht geringe Zelldichte aus. Je nach Gelenk und Lokalisation innerhalb des Gelenkes beträgt das Zellvolumen am Gesamtvolumen 1–3 %. Den bei Weitem größten Anteil am Gesamtvolumen hat Wasser mit 70–80 %. Organische und anorganische Bestandteile der extrazellulären Matrix erreichen einen Anteil von 20–30 %. Dabei handelt es sich vor allem um Kollagene und Proteoglykane.

Kollagene stellen den Hauptbestandteil der Trockenmasse der extrazellulären Matrix dar. Sie schaffen eine Rahmenkonstruktion, die dem Knorpel Struktur verleiht und seine Festigkeit garantiert. Proteoglykane und andere Bestandteile der extrazellulären Matrix werden wie in einer Maschenkonstruktion chemisch oder mechanisch eingeschlossen
Fehlende Heilung von Gelenkknorpel
Die Problematik der Regeneration des Knorpels hängt mit seiner besonderen Anatomie zusammen. Hyaliner Gelenkknorpel besitzt weder eine Vaskularisation noch eine lymphatische oder nervale Versorgung. Die Knorpelernährung erfolgt durch die Synovialflüssigkeit, die den Knorpel per Diffusion erreicht. Chondrozyten stellen ausdifferenzierte Zellen dar. Eine gesonderte Stammzellpopulation als Regenerationspool fehlt. Während es bei Verletzungen anderer Bindegewebe zu einer kaskadenartigen Entzündungsreaktion kommt, die zu einer Migration von Zellen mit regenerativer Potenz führt, fehlt dem Knorpel aufgrund seiner Avaskularität diese Fähigkeit. Neben der geringen Zellzahl wird die Abgrenzung der Chondrozyten durch die umgebende extrazelluläre Matrix von der Defektzone für die mangelnde Regenerationspotenz verantwortlich gemacht. Die restitutio ad integrum eines Knorpelschadens ist also nicht möglich. Als Reparaturphänomen kennt man lediglich ein durch Gelenkbewegungen induziertes Abrunden der Defektränder oder, wenn der subchondrale Knochen eröffnet ist, ggf. ein zusätzliches Auswandern von mesenchymalen Zellen in den Defekt. Dies führt zu einer Narbenbildung und bestenfalls zur Defektauffüllung mit fibrösem Knorpel.
Klinische und therapeutische Relevanz von Knorpelschäden
Die Bezeichnung „Knorpelschaden“ ist für sich allein sehr unspezifisch. Für die klinische und somit auch therapeutische Relevanz eines Knorpelschadens sind vor allem Lokalisation und Ausmaß, jedoch auch die Ätiologie des Schadens von entscheidender Bedeutung.
Lokalisation von Knorpelschäden
Es liegt auf der Hand, dass ein Knorpelschaden im lasttragenden Bereich eines Gelenkes gravierendere Folgen zeigt und rascher progredient ist als ein Schaden im nicht lasttragenden Bereich.
Klassifizierung von Knorpelschäden

Es gibt zahlreiche Klassifizierungen zur Beschreibung der Größe und vor allem Tiefe eines Knorpelschadens. Die gebräuchlichste in Deutschland ist die Outerbridge-Klassifizierung, welche allerdings die flächige Ausdehnung des Schadens nicht beschreibt:
Ätiologie des Knorpelschadens
Ein Defekt der knorpeligen Gelenkfläche kann traumatisch oder degenerativ bedingt sein. In vielen Fällen bleibt die Ätiologie ungeklärt.
Traumatischer Knorpelschaden
Traumatisch bedingte Knorpelschäden entstehen durch Gelenkkontusionen, -distorsionen oder -luxationen. Je nach Beteiligung des subchondralen Knochens unterscheidet man rein chondrale von osteochondralen Schäden bzw. Defekten. Nach leichteren Traumen sieht man ggf. lediglich ein Knorpelödem, häufig in Kombination mit einem Knochenödem (bone bruise). Gröbere Traumen führen ggf. zu Substanzdefekten, d. h. einer chondralen oder osteochondralen Abscherung (flake fracture). Traumatische Knorpelschäden sind mittels MRT gut nachweisbar. Knorpelläsionen können auch durch repetitive Mikrotraumen (z. B. beim Sportler) entstehen. Diese sind sowohl von der Morphologie als auch der Therapie dem degenerativen Knorpelschaden gleichzusetzen.

Degenerativer Knorpelschaden
Knorpelgewebe unterliegt einem natürlichen, altersbedingten Verschleiß. Dieser Verschleißprozess setzt jedoch ggf. früher ein, wenn bestimmte Voraussetzungen vorliegen. Hierzu zählen o. g. rezidivierende Mikrotraumen oder chronische Überlastung bei zu intensiver körperlicher Belastung, Gelenkfehlstellungen (Genua vara oder valga), Gelenkinstabilitäten (z. B. nach Kreuzbandruptur), Adipositas oder Bewegungsmangel. Daneben ist aber auch von einer intrinsischen Disposition zu Knorpelschäden auszugehen. Im Rahmen der Entstehung eines Knorpeldefektes kommt es initial zur Eröffnung der oberflächlichen Tangentialfaserschicht. Durch erhöhten Flüssigkeitseintritt werden die Kollagenfasern der Tangentialfaserschicht auseinandergedrückt und verlieren ihre Belastbarkeit. Im Weiteren werden diese Kollagenfasern demaskiert. Oberflächlich liegende Chondrozyten werden nekrotisch. Schreitet der Defekt fort, werden tiefere Schichten eröffnet und die Kollagenfaserarchitektur bis auf die tiefe Basalschicht zerstört. Die durch den Detritus initiierte Synovialitis führt über entzündliche Reaktionen, insbesondere die vermehrte Konzentration lysosomaler Enzyme, zusätzlich zur Destruktion. Durch die verschlechterte mechanische Funktion der Knorpelschicht wird die Lastübertragung gestört, mit der Folge, dass Veränderungen am subchondralen Knochen auftreten und sich sukzessive das klinische und radiologische Bild der Arthrose entwickelt.
Knorpelschäden sonstiger Ätiologien
Zu den sonstigen Ätiologien, die zu einem Knorpelschaden führen, gehören die Osteochondrosis dissecans, subchondrale Osteonekrosen wie der M. Ahlbäck sowie die primäre synoviale Chondromatose. Diffuse Knorpelläsionen können aber auch durch systemische Erkrankungen hervorgerufen werden. Hierzu zählen Gicht, Chondrocalcinose, Ochronose, Hämophilie, Erkrankungen des rheumatischen Formenkreises sowie bakterielle, paraund postinfektiöse Synovialitiden.
Behandlungsmethoden von Knorpelschäden
Es stehen eine Vielzahl von Therapieformen zur Behandlung von Knorpelschäden zur Verfügung. Wir möchten Ihnen einen Überblick über die verfügbaren Therapieformen geben und einen Therapie-Algorithmus aufstellen, der ihnen helfen soll, eine für ihren Patienten geeignete Therapie auszuwählen. Die Behandlungsmethoden von Knorpelschäden können folgenden Gruppen zugeordnet werden:
- Allgemeine Maßnahmen und Prophylaxe
- Physikalische Maßnahmen
- Physiotherapie
- Medikamentöse Therapie
- Alternative Verfahren
- Operative Therapie
Allgemeine Maßnahmen und Prophylaxe
Allgemeinmaßnahmen und Prophylaxe sind sicherlich ganz wichtige Säulen der Therapie von Knorpelschäden und der daraus resultierenden Arthrose. Eine Kernaussage lautet: „Bewegung ist gut – Überlastung ist schlecht!“ Runde, sanfte Bewegungen (Gehen, Walken, Gymnastik etc.) verbessern sowohl die Diffusion von Nährstoffen aus der Synovialflüssigkeit in den hyalinen Knorpel als auch den Tonus der gelenksteuernden Muskulatur. Stoßbelastungen oder abrupte Bewegungen (Sprünge, Stop-and-go-Sportarten; alpines Skifahren etc.) führen bei vorhandenem Knorpelschaden eher zu einer Progredienz. Eine Gewichtsreduktion bei Übergewicht und eine ausgewogene Ernährung unter Berücksichtigung der notwendigen Substanzen des Knorpelstoffwechsels sind sicherlich weitere Aspekte allgemeiner Maßnahmen.
Physikalischen Therapiemaßnahmen
Physikalische Therapiemaßnahmen umfassen all die, die unter Verwendung von Thermo- (Kälte/Wärme), Elektrooder Ultraschallbehandlung eine Schmerzreduktion, eine Entzündungshemmung und/oder eine Verbesserung des Gelenkstoffwechsels bewirken sollen. Im weitesten Sinne zählt hierzu auch die Gelenkentlastung mit orthopädischen Hilfsmitteln. Pufferabsätze und Einlagen können als Dämpfer Stoßbelastungen abmildern. Einlagen mit Außenranderhöhung bei Genua vara bzw. Innenranderhöhung bei genua valga sollen zu einer günstigeren Druckverteilung im Gelenk beitragen. Bandagen können durch Gelenkstabilisierung oder auch propriozeptiv eine verbesserte Gelenkbelastung unterstützen.
Physiotherapie

Bei der krankengymnastischen und physikalischen Therapie von Knorpelschäden gilt es, durch die Behandlung des betroffenen Gelenks, aber auch der umgebenden Strukturen, den Progress des Knorpelschadens zu minimieren und etwaige Reiz- und Schmerzzustände zu behandeln. Je früher eine solche Behandlung einsetzt, desto effektiver ist sie. Das Kniegelenk hat ein großes Bewegungsausmaß. Neben den Bandstrukturen ist es vor allem die Muskulatur, die für eine gute Stabilisierung des Gelenkes verantwortlich ist. Somit ist naheliegend, dass Übungen zur Muskelkräftigung einen breiten Raum einnehmen. Das Kniegelenk ist zudem als Teil der Bewegungskette Wirbelsäule – Hüfte – Knie – Sprunggelenk zu sehen. Die Detonisierung hypertoner und verkürzter Muskelgruppen sowie die Mobilisierung aller Gelenke der Bewegungskette haben eine große Bedeutung. Die in der Praxis angewendeten Techniken umfassen Krankengymnastik, Manuelle Therapie, Massagen, Reflexzonentechniken, Friktionen und Oszillationen, Thermotherapie (Hitze/Kälte) und die Elektrotherapie. Mangelnde Koordination und Propriozeption innerhalb der Bewegungskette können zu hohen Beanspruchungen des Kniegelenkes, aber auch zu einer erhöhten Verletzungsbzw. Überlastungsanfälligkeit des Knies führen. Koordinationsund Propriozeptionstraining sind deshalb fester Bestandteil der Behandlung, finden aber insbesondere auch Anwendung in der Prophylaxe von Knorpelschäden.
Medikamentöse Maßnahmen
Diese umfassen die systemische, oberflächliche oder intraartikuläre Applikation von Medikamenten. Als Stoffgruppen stehen insbesondere Analgetika, nicht-steroidale Antiphlogistika, Kortisonpräparate sowie Homöopathika zur Verfügung. Hyaluronsäure (siehe Aus der Praxis für die Praxis, S. 10), die als Medizinprodukt gilt, findet breite Anwendung. Eine weitere Therapiealternative stellt die intraartikuläre Applikation von biotechnologisch aufbereiteten körpereigenen Entzündungshemmern wie z. B. Autologous Conditioned Plasma, ACP (siehe ebenfalls S. 10), dar.
Alternative Verfahren
Es gibt eine nahezu unüberschaubare Menge an alternativen medikamentösen Therapieversprechen zur Prophylaxe und Behandlung von Knorpelschäden. Häufig handelt es sich hierbei um oral einzunehmende Substanzen, deren Wirkmechanismus teilweise ungeklärt ist und bei denen valide, vergleichende Studienergebnisse fehlen. Kritisch formuliert kann man von solchen Substanzen allenfalls einen Placeboeffekt erwarten. Weitere alternative Methoden sind Akupunktur und die Magnetfeldtherapie, die vor allem zur Schmerzreduktion dienen. Ein der Magnetfeldtherapie von manchen Seiten zugeschriebener Einfluss auf die Regeneration von Knorpelgewebe ist nicht sicher nachgewiesen und hat keine praktische Relevanz.
Operative Behandlungsverfahren bei Knorpelschaden bzw. Arthrose
Am Beispiel des Kniegelenks werden nachfolgend die wichtigsten operativen Behandlungsmethoden chondraler Schäden bzw. der Arthrose dargestellt. Grundsätzlich sind diese Möglichkeiten auch auf andere Gelenke übertragbar.
Arthroskopische Gelenklavage und Knorpelglättung
Die arthroskopische Gelenkspülung und Knorpelglättung (Chondroplastik) ist die einfachste operative Maßnahme zur Behandlung von Knorpelschäden. Hierbei wird Knorpeldetritus, das sind frei umherschwimmende oder lose Knorpelteile, aus dem Gelenk gespült. Zusätzlich wird ggf. die Oberfläche des geschädigten Knorpels sehr vorsichtig geglättet, um mechanisch störende Unebenheiten der Oberfläche zu beseitigen. In aller Regel zeigt eine solche Prozedur, für sich allein durchgeführt, allenfalls kurzfristigen Erfolg. Sie sollte deshalb nur ausnahmsweise zur Anwendung kommen: nach erfolgloser konservativer Therapie und vor Implantation einer Knie-Endoprothese.

Mikrofrakturierung/Pridiebohrungen
Bei lokal begrenzten Knorpelschäden 4. Grades, d. h. Knorpelschäden, die vollschichtig bis auf den Knochen reichen (siehe auch Abschnitt „Klassifizierung von Knorpelschäden“, Seite 3), kann durch Mikrofrakturierung bzw. Pridiebohrungen die Bildung von Ersatzknorpelgewebe stimuliert werden. Hierbei wird die Kortikalis des Knochens im Bereich des Knorpelschadens im Rahmen einer arthroskopischen Operation mit entsprechenden Instrumentarien perforiert. Mit der verletzungsbedingten Blutung kommt es zum Austritt von Stammzellen aus dem Knochenmark, die die Bildung von Ersatzfaserknorpel induzieren. Eine Mikrofrakturierung ist dann sinnvoll, wenn lediglich ein umschriebener Grad-4-Knorpelschaden vorliegt und der übrige Gelenkknorpel jedoch weitestgehend intakt ist.
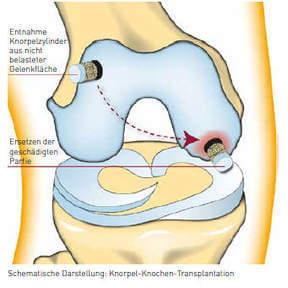
Knorpel-Knochen-Transplantation
Der autologe Transfer von osteochondralen Zylindern ist eine weitere Methode zur operativen Behandlung von Grad-4- Knorpelschäden. Bei der Knorpel-Knochen-Transplantation werden arthroskopisch Knorpel-Knochen-Zylinder aus einer wenig belasteten Fläche des Gelenks entnommen und in einen stark belasteten, zuvor passend ausgebohrten Defektbereich verpflanzt. Dadurch wird der stark belastete Defektbereich mit hochwertigem, hyalinem Knorpel gedeckt. Es können Knochenzylinder mit unterschiedlichen Durchmessern entnommen werden, wobei der größte Durchmesser 12 mm ist. Die Ergebnisse dieses Operationsverfahrens sind bei kleineren, umschriebenen Knorpelschäden (bis ca. 2 cm2) im lasttragenden Bereich eines Gelenkes gut. Die klinischen Ergebnisse bei der Deckung größerer Defekte durch die Kombination mehrerer Zylinder im Sinne einer Mosaikplastik sind häufig leider nicht befriedigend. Zudem gilt zu bedenken, dass bei einer Knorpel-Knochen-Transplantation auch Schäden an gesunden Knorpelflächen geschaffen werden, die zu Beschwerden an der Zylinder- Entnahmestelle und sogar zu einer Arthrose in einem weiteren Gelenkkompartiment führen können. Der Anwendungsbereich der Knorpel-Knochen-Transplantation ist insgesamt recht eingeschränkt. Sie zeigt im klinischen Outcome häufig keine wesentlichen Vorteile gegenüber der Mikrofrakturierung (siehe oben).

Chondrozyten-Transplantation
Für die Chondrozyten-Transplantation müssen im Rahmen einer Arthroskopie Knorpelzellen entnommen und im Labor unter einer Nährlösung gezüchtet werden. Bei einem zweiten Eingriff werden mit speziellen Techniken die Chondrozyten in den Defektbereich eingebracht. Zielsetzung ist ein vollständiges Ausheilen des Knorpelschadens mit körpereigenem, hyalinem Knorpel. Leider ist derzeit die Indikation für dieses grundsätzlich vielversprechende Verfahren sehr eingeschränkt. Derzeit können nur Patienten mit umschriebenem Knorpelschaden behandelt werden. Die Anwendung bei fortgeschrittenem, multifokalem Knorpelschaden oder fortgeschrittener Arthrose ist nicht möglich. Für die Methode müssen die Patienten sorgfältig ausgesucht werden. Insgesamt ist bei diesem innovativen Behandlungsverfahren in Zukunft mit Weiterentwicklungen zu rechnen, um es dann häufiger bei Knorpelerkrankungen einsetzen zu können.

Umstellungsosteotomie
Bei ausschließlich medialer bzw. lateraler Gonarthrose ist ggf. eine Umstellungsosteotomie zur Entlastung des einseitig verschlissenen Gelenkkompartiments indiziert. Bei medialer Gonarthrose wird das Kniegelenk valgisiert, bei lateraler Gonarthrose varisiert. Heutzutage erfolgt dies in aller Regel als Open-wedge-Technik. Nach schräger Osteotomie des Tibiakopfes bzw. des distalen Femurs, erfolgt ein Aufklappen des Osteotomiespalts und anschließend eine winkelstabile Plattenosteosynthese. Häufig wird eine solche Operation mit einer Mikrofrakturierung (s. o.) kombiniert, sodass sich ggf. Ersatzgewebe im Bereich des Knorpeldefektes bilden kann.
Endoprothese Kniegelenk
Bei fortgeschrittenem Knorpelschaden, d. h. dem Vollbild der Gonarthrose, ist die Versorgung des Patienten mit einer Gelenkendoprothese indiziert. Man unterscheidet hierbei grundsätzlich zwischen partiellem (unikondylär) und vollständigem (bikondylär) Gelenkersatz.
Mono-/unikondyläre Knieprothese (Schlitten-Prothese)
Die klassische Indikation für die monokondyläre Knieprothese, häufig auch Schlittenprothese genannt, ist der monokompartimentelle Verschleiß des Gelenkes, in aller Regel des medialen Kompartimentes. Die klinischen Ergebnisse bei lateraler Gonarthrose sind aufgrund der Kniekinematik deutlich schlechter. Liegen in den übrigen Gelenkabschnitten bereits fortgeschrittene Knorpelschäden vor, hat der Patient eine zu große Abweichung von der natürlichen Beinachse (Genu varum) oder bestehen höhergradige Bandinstabilitäten, sollte keine Schlittenprothese implantiert werden. Minimal invasive Techniken erlauben die Implantation der Prothesenkomponenten mit geringerem Weichteiltrauma. In aller Regel werden sowohl die femorale als auch die tibiale Gelenkkomponente mit Palacos (Knochenzement) fixiert. Der unikondyläre Schlitten beeinflusst die Kinematik des Kniegelenkes nur geringfügig. Das ermöglicht eine schnellere Mobilisation des Patienten. Die Beweglichkeit ist meist besser als nach konventioneller Knie-TEP. Insgesamt gilt die Implantation eines unikondylären Schlittens als sehr anspruchsvolle Operation, die jedoch gerade bei jüngeren Patienten (55–65 Jahre) exzellente klinische Ergebnisse zeigt.

Bikondylärer Oberflächenersatz
Bei fortgeschrittenem Gelenkverschleiß insbesondere mehrerer Gelenkkompartimente und suffizienter Bandstabilität ist der bikondyläre Gelenkersatz indiziert. Verbesserungen des Prothesendesigns haben dazu geführt, dass bei modernen Knieprothesen möglichst viele der natürlichen Strukturen erhalten bleiben und lediglich die verschlissenen Gelenkflächen überkront werden. Durch ein vielfältiges Angebot an Prothesenmodellen, u. a. auch geschlechtsspezifische Modelle, haben sich Individualprothesen nicht durchsetzen können. Aufgrund der hohen Primärstabilität und geringer Lockerungsraten werden in aller Regel beide Prothesenkomponenten einzementiert. Nach Implantation einer Knieprothese kann der Patient ein schmerzfreies oder zumindest schmerzarmes, im Alltagsleben gut belastbares Kniegelenk erwarten. In den ersten Monaten besteht häufig ein vermehrtes Spannungsgefühl, meist gepaart mit einer Überwärmung des Gelenkes. Häufig verbleibt eine Beugeeinschränkung gegenüber der physiologischen Beugefähigkeit, die aber nur selten als einschränkend empfunden wird. Die 20-Jahre-Überlebenswahrscheinlichkeit eines bikondylären Oberflächenersatzes liegt heute bei 70–80 %.
Behandlungsstrategien bei Knorpelschäden
Aus praktischer Sicht muss der Arzt jeden Patienten nach individuellen Kriterien beraten und behandeln. Hierbei müssen krankheitsspezifische und patientenspezifische Faktoren unterschieden werden. Krankheitsspezifische Faktoren bei der Beratung des Patienten:
- Lokalisation des Knorpelschadens (mediales, laterales, retropatellares Kompartiment, tibial, femoral, patellar)
- Ausmaß des Knorpelschadens (Größe und Tiefe des Defekts)
- Ausmaß und Charakter der Gelenkentzündung/Synovialitis (akut/chronisch, lokalisiert, generalisiert)
- Belastungsachse, Fehlstellung (X-Bein, O-Bein)
Genese des Knorpelschadens (traumatisch/degenerativ) Patientenspezifische Faktoren bei der Beratung des Patienten:
- Alter und Anspruchsniveau (Sportwunsch, Grad körperlicher Aktivität)
- Comorbiditäten (z. B. Übergewicht, koronare Herzerkrankung, Diabetes mellitus, maligne Erkrankungen)
- Compliance (besonders bei langer Rehabilitationsphase)
- Berufliche Situation (Ausfallzeiten durch längere Behandlungs-/Rehabilitationsphase)
- Ökonomie (Erstattungsmöglichkeit und Finanzierbarkeit der Therapie)

Welches Behandlungsverfahren für welchen Patienten das Beste ist, hängt von zahlreichen Faktoren ab. Die richtige Entscheidung hierüber erfordert vom behandelnden Arzt umfassende Kenntnisse über die Art und Erfolgsaussichten der einzelnen Therapieoptionen. Der Zugriff auf wissenschaftlich gesicherte Ergebnisse aus der Literatur bleibt in vielen Fällen unbefriedigend, da für einen Großteil der Therapieoptionen keine gesicherten Ergebnisse nach den Kriterien der evidence-based medicine bestehen.
Unser praktisches Vorgehen bei Behandlung von Knorpelschäden am Kniegelenk sieht in den allermeisten Fällen folgendermaßen aus:
- Anamnestische Analyse bezüglich dessen, was den Patienten am meisten an seinem Kniegelenk stört (Schmerz? Schwellung?) und welchen Anspruch er hat (Sport? Beruf?)
- Klinische und apparative Analyse des Knorpelstatus (Röntgen, MRT)
- Erläuterung der Therapieoptionen und der zu erwartenden Ergebnisse. Wichtig ist, dass dem Patienten eine realistische Vorstellung vermittelt wird, welches Ergebnis zu erwarten ist und dass eine Heilung des Knorpelschadens bzw. der Arthrose nicht möglich ist.
- In aller Regel empfehlen wir eine stufenweise Behandlung, d. h. beginnend mit Allgemeinmaßnahmen, topischer antiphlogistischer Therapie und Physiotherapie. Bei ausbleibender Besserung orale Antiphlogistika, ggf. einmalige intraartikuläre Kortikoid-Injektion und nachfolgend fünfmalige Hyaluronsäure-Injektion.
- Operative Maßnahmen stehen in aller Regel erst nach ausbleibender Besserung trotz konservativer Therapie an.
Aus der Praxis für die Praxis
Intraartikuläre Injektionsbehandlungen bei Knorpelschäden werden kontrovers diskutiert. Wir möchten Ihnen „aus der Praxis für die Praxis“ eine Übersicht über Wirkungsweise, Anwendung und wissenschaftliche Bewertung von zwei Behandlungsmethoden geben, nämlich der recht etablierten Hyaluronsäure-Therapie und der neuartigen ACP -Therapie.
Hyaluronsäure-Behandlung
Wirkungsweise
Synovialflüssigkeit enthält u. a. Hyaluronsäure. Hyaluronsäure hat eine visköse Konsistenz und ist für ein optimales Gleitverhalten der Gelenkpartner mitverantwortlich. Bei Arthrose verändert sich die Zusammensetzung der Synovialflüssigkeit. Unter anderem scheint es zu einer Veränderung der gelenkeigenen Hyaluronsäure-Synthese zu kommen, mit der Folge, dass die Synovia weniger viskös ist und das Gleitverhalten der Gelenkpartner sich verschlechtert. Synthetisch hergestellte Hyaluronsäure, die in den Gelenkraum injiziert wird, soll neben einer unmittelbar verbesserten Lubrikation dazu beitragen, die körpereigene Synthese von Hyaluronsäure zu fördern. Die therapeutische Vorstellung ist, dass neben einer unmittelbaren symptomatischen Verbesserung der Arthrose-bedingten Beschwerden die Progredienz der Knorpeldegeneration minimiert wird.
Anwendung
Je nach Gelenk und Arthrosegrad werden zwischen drei und fünf Injektionen mit Hyaluronsäure in das betroffene Gelenk durchgeführt. Die Injektionen sollten einmal wöchentlich erfolgen. Bei leichteren Knorpelschäden reicht ggf. eine einmalige Injektionsserie von 3 bis 5 Injektionen. Bei mittelschweren Knorpelschäden sollten die Injektionen ggf. im Abstand eines Jahres wiederholt werden. Bei fortgeschrittener Arthrose können die Injektionen auch häufiger, d. h. ggf. halbjährig durchgeführt wer
Wissenschaftliche Bewertung
In den vergangenen Jahren hat sich neben der medikamentösen und physikalischen Therapie zunehmend auch der Einsatz von Hyaluronsäure im Rahmen der Arthrose-Therapie etabliert. Inzwischen wurde die Hyaluronsäure-Therapie von nationalen und internationalen Fachgesellschaften in die Therapieempfehlungen der Arthrose-Behandlung mit aufgenommen. In den Leitlinien der DGOOC (Deutsche Gesellschaft für Orthopädie und orthopädische Chirurgie) werden die Systemic Slow Acting Drugs, zu denen die Hyaluronsäure gehört, zusammen mit der symptomatischen Therapie beispielsweise mit NSAR in der 1. Stufe der Therapie eingeordnet. Auch die Task-Force der EULAR (European League against Rheumatism) hat die Hyaluronsäure-Therapie in das empfohlene Therapiemanagement mit aufgenommen. Weiterhin bestätigt auch der aktuelle Cochrane-Review, dass intraartikuläre Hyaluronsäure eine wirksame und sinnvolle Arthrose-Therapie ist, besonders im Hinblick auf die Parameter Schmerz, Funktion und Allgemeinbeurteilung durch den Patienten. Die Analyse bezog sich auf 17 verschiedene Hyaluronsäure-Produkte. Insgesamt wurden 63 Studien ausgewertet.
ACP-Behandlung (Autologes Conditioniertes Plasma) PRP-Therapie (Platelet Rich Plasma)
Wirkungsweise
Grundlage für die nunmehr seit mehr als zehn Jahren mit zunehmendem Erfolg eingesetzte ACP- bzw. PRP-Behandlung ist das Wissen, dass in Blutplasma und Thrombozyten Wundheilungsfaktoren in einer gewissen Konzentration vorhanden sind.
Bei diesen Wundheilungsfaktoren handelt es sich zum einen um Wachstumsfaktoren, die zur verbesserten Regeneration der Zellen, gesteigerten Produktion von Kollagen und verbesserten Blutversorgung des Gewebes führen. Zum anderen handelt es sich um anti-inflammatorische Faktoren, die zur Reduktion der Gewebsentzündung bei degenerativen Prozessen und Verletzungen beitragen. Mit der ACP- bzw. PRP-Therapie können Arthrose-bedingte Beschwerden des Patienten reduziert und die eingeschränkte Lebensqualität ggf. verbessert werden. Die ACP- bzw. PRPTherapie führt zu einer Linderung der Entzündung und somit zu einer Reduktion der Schmerzen und verbesserten Beweglichkeit des Gelenks. Weiterhin hat die Therapie eine positive Wirkung auf die Knorpelzellen und den darunter liegenden Knochen. Eine Heilung der Arthrose kann aber, obwohl in der Laienpresse häufig so dargestellt, auch durch die ACP- bzw. PRP-Therapie selbstverständlich nicht erzielt werden.
Anwendung
Das Prinzip der Behandlung mit körpereigenen Blutbestandteilen wie der ACP- bzw. PRP-Therapie besteht darin, dass in einem ersten Schritt dem Patienten zunächst ca. 20 ml Blut entnommen werden. Hieraus werden durch Zentrifugieren Blutplasma und Thrombozyten, in denen sich die wachstumsfördernden und entzündungshemmenden Mediatoren befinden, isoliert. Unmittelbar anschließend wird das so erhaltene Plasma (ACP bzw. PRP) mit seinen konzentrierten Wundheilungsfaktoren in das betroffene Gelenk oder an die erkrankte Struktur injiziert. Die Behandlung wird im Allgemeinen 3- bis 4-mal im wöchentlichen Abstand durchgeführt. Da ACP bzw. PRP autolog generiert wird, ist die Behandlung risikoarm. Unverträglichkeiten oder allergische Reaktionen bestehen faktisch nicht.
Wissenschaftliche Bewertung
Die genauen Abläufe der körpereigenen Heilung sind derzeit noch nicht im Einzelnen bekannt. Man hat aber in zahlreichen Studien die Wirksamkeit und das breite Einsatzgebiet der ACP- bzw. PRP-Therapie bei Unterstützung von natürlichen Heilungsprozessen nachweisen können.

